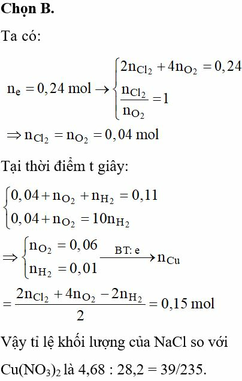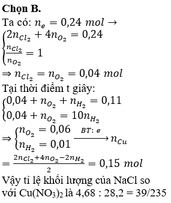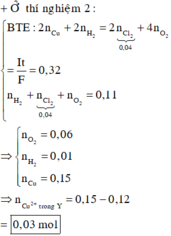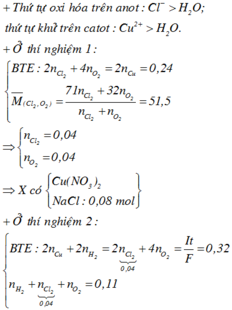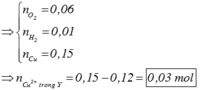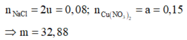Điện phân dung dịch X chứa 0,2 mol NaCl và a mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi, hiệu suất 100%), sau một thời gian, thu được dung dịch T vẫn còn màu xanh, có khối lượng giảm 43a gam so với dung dịch ban đầu. Cho m gam bột Fe vào T, sau khi phản ứng xảy ra hoàn toàn, thu được m – 3,6a gam kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của a là A. 0,6 B. 0,4 C. 0,3 D. 0,5
Đọc tiếp
Điện phân dung dịch X chứa 0,2 mol NaCl và a mol Cu(NO3)2 (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi, hiệu suất 100%), sau một thời gian, thu được dung dịch T vẫn còn màu xanh, có khối lượng giảm 43a gam so với dung dịch ban đầu. Cho m gam bột Fe vào T, sau khi phản ứng xảy ra hoàn toàn, thu được m – 3,6a gam kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của a là
A. 0,6
B. 0,4
C. 0,3
D. 0,5